металл легче всего окисляется
Какой металл легче всего окисляется?
Однозначного ответа на этот вопрос нет‚ так как скорость окисления зависит от множества факторов‚ включая влажность‚ температуру и наличие кислорода. Однако‚ среди наиболее реактивных металлов‚ легко вступающих в реакцию с кислородом‚ находятся щелочные металлы‚ такие как литий‚ натрий и калий. Их высокая реакционная способность обусловлена их электронными свойствами.
Окисление металлов – это сложный электрохимический процесс‚ представляющий собой взаимодействие металла с окружающей средой‚ приводящее к образованию на его поверхности оксидной пленки или других соединений. Суть процесса заключается в потере металлом электронов‚ которые переходят к окислителю‚ чаще всего кислороду. Скорость окисления‚ или коррозии‚ зависит от множества факторов‚ и ее понимание имеет огромное практическое значение в различных областях‚ от строительства и машиностроения до производства электроники и химической промышленности.
Важно различать два основных типа окисления⁚ химическое и электрохимическое. Химическое окисление происходит при прямом взаимодействии металла с окислителем‚ например‚ при горении магния на воздухе. Электрохимическое окисление‚ более распространенное в обычных условиях‚ протекает в присутствии электролита (воды‚ растворов солей и т.д.) и сопровождается образованием гальванических элементов на поверхности металла. В этом случае металл выступает в роли анода‚ отдавая электроны‚ а катодом может быть другой металл‚ углерод или даже сам окисел металла.
Образование оксидной пленки на поверхности металла может как замедлять‚ так и ускорять дальнейшее окисление. В некоторых случаях‚ например‚ у алюминия‚ образуется плотная и защитная оксидная пленка‚ препятствующая дальнейшему проникновению кислорода и влаги. В других случаях‚ например‚ у железа‚ образуется рыхлая ржавчина‚ которая не защищает металл и способствует дальнейшей коррозии. Поэтому изучение процессов окисления металлов – это ключ к пониманию их долговечности и надежности в различных условиях эксплуатации. Толщина‚ структура и свойства образующейся оксидной пленки‚ а также ее взаимодействие с окружающей средой‚ являются критическими факторами‚ определяющими скорость и характер коррозионного процесса. Именно поэтому исследование окисления металлов являеться важной задачей для материаловедения и многих других научных дисциплин.
Наиболее реактивные металлы⁚ щелочные и щелочноземельные
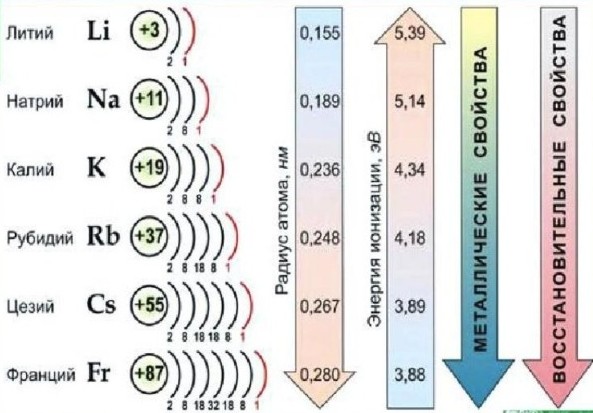
Среди всех металлов наиболее склонны к окислению щелочные и щелочноземельные металлы. Эта высокая реактивность обусловлена их электронным строением. Щелочные металлы (литий (Li)‚ натрий (Na)‚ калий (K)‚ рубидий (Rb)‚ цезий (Cs) и франций (Fr)) имеют всего один валентный электрон на внешней электронной оболочке. Этот электрон относительно слабо связан с атомным ядром‚ что делает его легко отдаваемым при взаимодействии с окислителями‚ такими как кислород. В результате образуются катионы щелочных металлов с зарядом +1 и соответствующие оксиды.
Щелочноземельные металлы (бериллий (Be)‚ магний (Mg)‚ кальций (Ca)‚ стронций (Sr)‚ барий (Ba) и радий (Ra)) имеют два валентных электрона‚ которые также относительно легко отщепляются. Они образуют катионы с зарядом +2 и оксиды с соответствующей стехиометрией. Однако‚ щелочноземельные металлы‚ как правило‚ несколько менее реактивны‚ чем щелочные‚ из-за более сильного притяжения валентных электронов к ядру.
Реактивность щелочных и щелочноземельных металлов настолько высока‚ что они бурно реагируют с водой‚ выделяя водород и образуя гидроксиды. Хранить их необходимо в инертной атмосфере‚ например‚ в аргоне или парафине‚ чтобы предотвратить их быстрое окисление на воздухе. Скорость окисления этих металлов сильно зависит от температуры и влажности. При повышении температуры реакция ускоряется‚ а наличие влаги способствует электрохимическому окислению. Интересно отметить‚ что несмотря на высокую реактивность‚ некоторые из этих металлов‚ например‚ магний‚ находят широкое применение в различных областях благодаря своим уникальным свойствам‚ таким как легкость и прочность. Однако‚ для использования этих металлов необходимо учитывать их склонность к окислению и принимать соответствующие меры для защиты от коррозии.
Важно подчеркнуть‚ что положение в ряду активности металлов является лишь относительной характеристикой‚ и скорость окисления конкретного металла зависит от совокупности факторов‚ а не только от его положения в электрохимическом ряду напряжений.
Алюминий⁚ пассивация и реальная скорость окисления
Алюминий‚ несмотря на свою относительно высокую активность в электрохимическом ряду напряжений‚ в обычных условиях проявляет удивительную устойчивость к коррозии. Это объясняется явлением пассивации. Когда алюминий контактирует с кислородом воздуха‚ на его поверхности быстро образуется тонкая‚ плотная и прочная оксидная пленка Al2O3. Эта пленка является барьером‚ препятствующим дальнейшему доступу кислорода к металлу и‚ следовательно‚ замедляет процесс окисления. Толщина этой защитной пленки составляет всего несколько нанометров‚ но она достаточно прочна и инертна‚ чтобы эффективно защищать основной металл от дальнейшей коррозии.
Однако‚ важно понимать‚ что пассивация – это динамический процесс. Оксидная пленка постоянно разрушается и восстанавливается. Если пленка повреждается механически (царапинами‚ истиранием) или химически (воздействием агрессивных веществ)‚ то скорость окисления алюминия резко возрастает‚ пока не восстановится защитный слой. В таких условиях алюминий может достаточно быстро окисляться‚ особенно в присутствии электролитов‚ например‚ в соленой воде.
Таким образом‚ реальная скорость окисления алюминия в значительной степени определяется целостностью и качеством его пассивирующей оксидной пленки. Факторы‚ влияющие на образование и стабильность этой пленки‚ включают в себя чистоту металла‚ температуру‚ влажность‚ pH среды и наличие различных химических веществ. В некоторых условиях‚ например‚ при высоких температурах или в присутствии сильных щелочей‚ пассивирующая пленка может разрушаться‚ и алюминий может окисляться с высокой скоростью. Поэтому‚ хотя алюминий и находится в ряду активных металлов‚ его практическая устойчивость к коррозии в обычных условиях намного выше‚ чем можно было бы ожидать‚ основываясь только на его электрохимическом потенциале. Это делает алюминий ценным материалом для различных применений‚ где требуется сочетание легкости‚ прочности и коррозионной стойкости.
Следует отметить‚ что специальные обработки поверхности алюминия‚ такие как анодирование‚ позволяют увеличить толщину и прочность пассивирующей пленки‚ значительно повышая коррозионную стойкость материала.